AhmadDahlan.NET – Mesin kalor adalah salah implementasi prinsip termodinamika yang paling banyak dimanfaatkan manusia. Proses pembakaran yang terjadi di dalam mesin kalor akan dikonversi ke dalam energi gerak dan selanjutnya disalurkan di roda-roda gigi lalu dimanfaatkan manusia. Dalam kondisi ideal, proses pembakaran ini bisa terjadi dalam 4 jenis keadaan yakni Isobar, Isohoric, Isotermis dan Adiabatis.
Daftar Isi
A. Usaha Pada Termodinamika
Dalam pengamatan usaha yang dilakukan mesin panas di Termodinamika, sebuah kerangka acuan tinjauan yakni sistem dan lingkungan. Gas dikatakan melakukan usaha jika menghasilkan gerak pada piston dalam kasus ini pembakaran gas di dalam piston disebut sistem dan gerak yang terjadi disalurkan pistion ke engkel mesin disebut lingkungan.
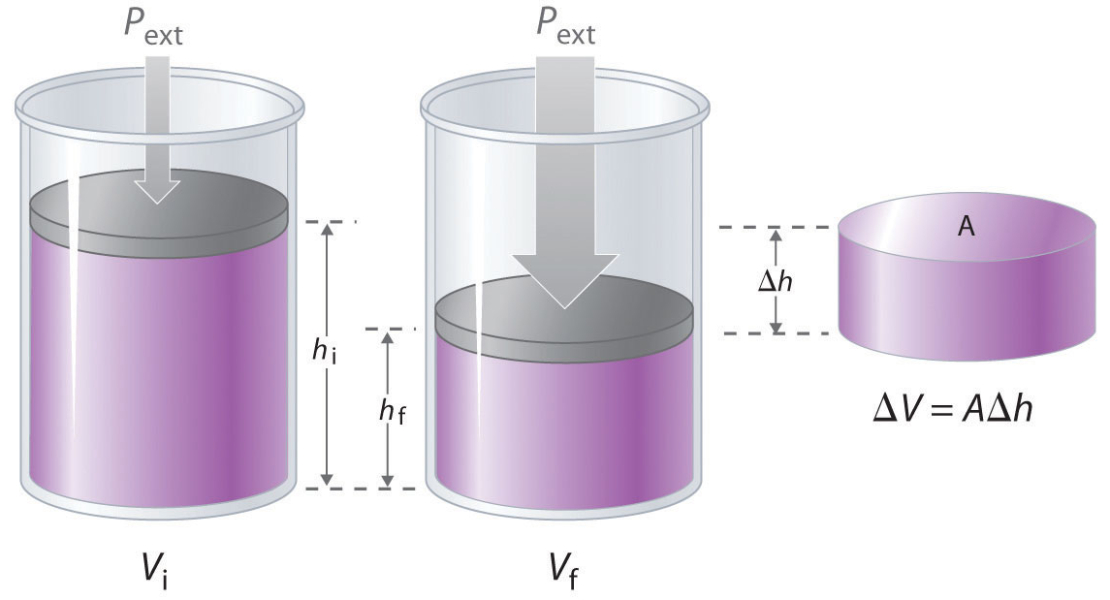
Misalkan sejumlah gas berada dalam ruang tertutup yang bisa bergerak, kemudian dipanaskan sehingga terjadi ekspansi dalam ruangan. Ekspansi ini akan menghasilkan gaya yang mendorong penutup seperti ilustrasi di bawah ini :

Besar usaha yang dihasilkan oleh ekspansi gas tersebut adalah :
W =\int F.ds
Tutup piston pada silinder tersebut adalah luasan (A) yang bergerak karena ada tekanan (P) dari sisi gas dengan demikian :
W =\int PA.ds
Jika A.s = V, maka persamaan ini ditulis ulang menjadi :
W =\int P.dV
Persamaan ini disebut persamaan umum suaha termodinamika. Pada saat gas memuai maka V memiliki nilai positif maka nilai W akan bernilai positif atau dengan kata lain sistem melakukan usaha demikian pula sebaliknya jika gas ditekan dari luar (diberi gaya dari luar) maka nilai V akan negatif sehingga nilai W juga ikut negatif.
B. Proses Termodinamika
Sebuah sistem termodinamika diberikan energi panas maka akan terjadi perubahan keadaan, namun untuk menyederhakan kita tinjau Usaha dari 4 kondisi yakni Isobaris, Isohoric, Isotermal dan Adiabatik.
1. Usaha Isotermal
Usaha isotermal adalah kejadian yang terjadi dengan kondisi suhu yang sama. Prosesnya ada dua kemungkinan misalnya gas ditambahkan sehingga terjadi ekspansi karena penambahan volume atau yang kedua diberikan panas secara perlahan sehingga perubahan suhu tidak terjadi dan hanya terjadi pada perubahaan volume saja.

W =\int_{V_1}^{V_2} P.dVkarena pV = nrT maka persamaan ini dapat ditulis
W =\int_{V_1}^{V_2}nRT \frac{dV}{V}maka
W = nRT \ln V|_{V_1}^{V_2}atau
W = nRT \ln \frac{V_2}{V_1}2. Usaha Isohorik
Isohorik adalah keadaan termodinamis dengan kondisi volume yang sama. Misalkan sebuah gas yang disimpan dalam sistem dengan wadah kaku dipanaskan maka perubahan tekanan akan berdampak pada perubahan suhu gas dalam sistem.

Pada proses isohorik, tidak ada perubahan voleme yang terjadi sehingga nilai dV = 0, dengan demikian tidak ada perubahan sehingga
W =\int_{V_1}^{V_2} P.dV =03. Usaha Isobarik
Proses isobarik adalah perubahan keadaan gas pada kondisi tekanan yang sama.

Pada proses Isotermis, perubahan terjadi dalam keadaan tekanan tetap sehingga usahanya adalah :
W =P\int_{V_1}^{V_2} dVjadi usahanya adalah :
W = PV|_{V_1}^{V_2}atau
W = P (\Delta V)
4. Proses Adiabatik
Proses adiabatik adalah suatu proses perubahan keadaan gas di mana tidak ada kalor (Q) yang masuk atau keluar dari sistem (gas). Proses ini dapat dilakukan dengan cara mengisolasi sistem menggunakan bahan yang tidak mudah menghantarkan kalor atau disebut juga bahan adiabatik. Adapun, bahan-bahan yang bersifat mudah menghantarkan kalor disebut bahan diatermik.
Persamaan ini akan dibahas secara khusus untuk porses Adiabatik
Leave a Reply
You must be logged in to post a comment.