AhmadDahlan.NET – Teori model atom Thomson telah berhasil menjelaskan mengenai keberadaan elektron pada struktur atom dan akhirnya menyodorkan teori Kue Kismis dimana Proton diselimuti elektron seperti coklat pada kue kismis. Hanya saja teori ini gagal menjelaskan mengenai beberapa hasil percobaan mengenai struktur atom secara detail termasuk memberikan gambaran mengenai ukuran dan posisi dari Proton dan Elektron.
Daftar Isi
Ernest Rutherford bersama kedua mahasiswanya, Hans Geiger dan Erners Masreden kemudian mengajukan model atom berdasarkan hasil percobaan hamburan partikel alfa.
Percobaan Hamburan Sinar Alfa
Teori Atom Rutherford didasarkan pada percobaan hamburan sinar alfa dari He2+ pada lembar logam tipis. Rutherford kemudian mengamati jalur yang terbentuk dari hamburan sinar alfa.
Dalam percobaannya, Rutherford menembahkan gelombang sinar alfa berenergi tinggi dari sebuah sumber radioaktif ke sebuah logam emas tipis dengan ketebalan 100 nm. Sebuah layar berbahan fluorescent zinc sulfid diletakkan disekitar lembaran emas untuk mengamati jalur yang terbentuk oleh partikel hamburan.
Observasi yang dilakukan menghasilkan :
- Sejumlah besar partikel hamburan hanya melewati logam dengan jalur lurus dan membuat kilauan cahaya. Rutherforod menyimpulkan sebagain besar ruang dalam atom kosong
- Sejumlah besar partikel hamburan dibelokkan dengan sudut kecil oleh logam karena tolakan antar partikel bermuatan positif. Sehingga Rutherford menyimpulkan muatan positif pada partikel ini lebih kecil dari total volumenya.
- Sejumlah partikel dibelokkan kuat bahkan hampir membentuk sudut 180o. Rutherford menyebutnya partikel dengan muatan postif kuat ini sebagai Nukleus.
- Rutherford menyebutkan bahwa sebagian besar massa atom terkonsentrasi di Nuklues.
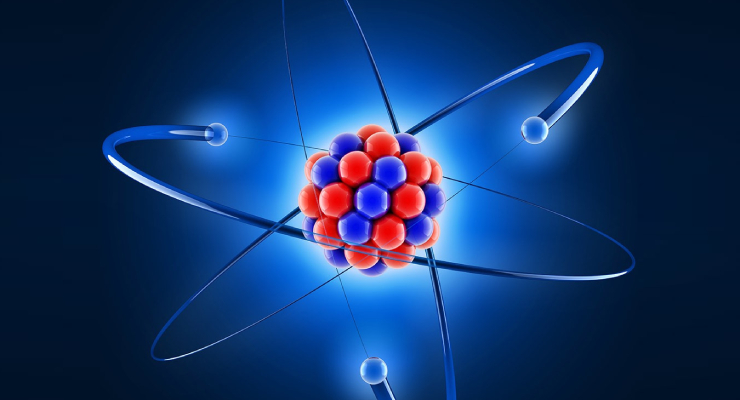
Model Atom Rutherford
Berdasarkan percobaan tersebut, Rutherford menyimpulkan bahwa :
- Nukleus berisi partikel bermuatan positif dan memiliki massa yang paling besar dari struktur atom. Nuklues ini selanjutnay disebut sebagai inti atom.
- Bentuk Struktur atom menyerupai bola.
- Elektron bergerak dengan kecepatan tinggi mengelilingi inti atom. Orbit elektron berbentuk melingkar dengan memanfaatkan gaya elektrostatis.

Keterbatasan Teori Atom Ruttherford
Meskipun teori model atom yang diajukan Rutherford berdasarkan hasil percobaan namun teori atom gagal dalam menjelaskan beberapa hal :
- Rutherford menjelaskan bahwa elektron mengeliling Nuclues pada jalur tetap yang disebut orbits. Hal ini gagal menjelaskan fenomena radiasi gelombang elektromagnetik yang dipancarkan elektron pada saat dipercepat. Jika radiasi ini dihitung menggunakan persaman gelombang Maxwell maka energi pada elektron akan habis dan lama-lama kelamaan akan jatuh ke inti sesuai dengan teori gaya elektrostatis yang diajukan Rutherford. Waktu yang dibutuhkan sampai akhirnay elektron jatuh ke inti hanya 8 sampai 10 sekon.
- Rutherford sama sekali tidak memberikan penjelasan detail mengenai susunan elektron sehingga teorinya tidak lengkap.
Meskipun terbatas dalam menjelaskan fenomena radiasi gelombang elektromagnetik pada partikel yang diberi energi dari luar, Model Atom Rutherford adalah dasar yang baik dalam pengembangan teori atom modern dan hukum-hukum mekanika kuantum.
Leave a Reply
You must be logged in to post a comment.