Ahmaddahlan.NET – Persamaan-persamaan gas ideal yang disusun berdasarkan hasil percobaan Boyle dan Guy-Lussac berlaku dengan baik di gas-gas ideal dengan tekanan rendah dan temperatur yang tinggi. Pada percobaan mengenai karakteristik gas pada suhu rendah dan tekanan tinggi ternyata menghasilkan Grafik P-V yang dihasilkan menyimpang dari hukum-hukum gas ideal. Penyebabnya tidak lain adalah gaya tarik antar partikel gas pada suhu rendah dan tekanan tinggi tidak dapat diabaikan sebagaimana yang terjadi pada gas-gas ideal. Volume molekum pada gas tidak dapat diabaikan begitu saja.
Daftar Isi
Penyimpangan perilaku gas pada kondisi suhu rendah dan tekanan tinggi dapat dinyatakan dengan perbandingan volum molarnya (Volume 1 mol gas) :
\bar V_{id}=\frac{RT}{P}Perbandingan ini disebuat sebagai faktor komprasibilitas (Z) yang dinyatakan dalam bentuk :
Z=\frac{\bar V}{\bar V_{id}}=\frac{P\bar V}{RT}pada gas ideal, Z = 1 dan nialinya tidak bergantung pada tekanan dan suhu namun pada gas tidak ideal, nilai Z tidak selalu 1. Z merupakan nilai yang bergantung pada suhu dan tekanan Z(T,P). Berdasarkan percobaan nilai Z berkisar antara 0,6 sampai 2,2.

Nilai PV pada gas-gas nyata ini hampir sangat sedikit mendekati gas ideal dan pada konisi terbatas seperti pada tekanan 0 atm. Nilai Z juga tidak menunjukkan hubungan linier dimana semakin tinggi tekanan ternyata tidak membuat nilai Z semakin meningkat kecuali pada gas H2.
Penyimpanan nilai Z semakin rumit pada gas-gas Poliatomik dengan nilai yang turun pada saat tekanan naik. Uniknya Masing-masing gas memiliki kriteria unik dan titik kritis yang menjadi titik balik peningkatan niali Z.
A. Persamaan Van Der Walls untuk Gas Nyata
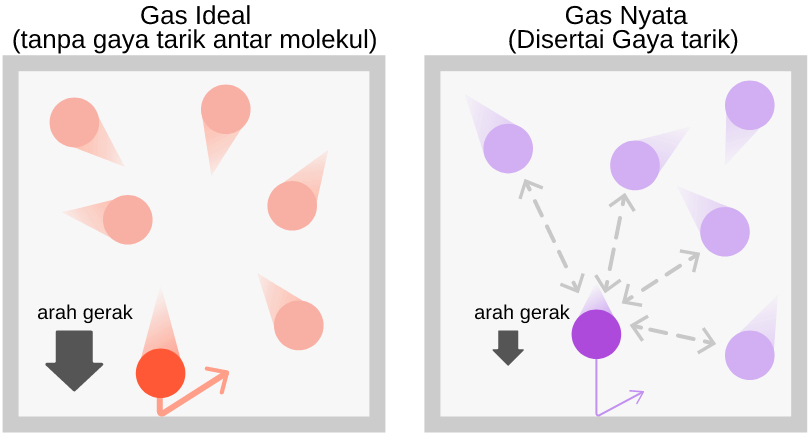
Gas-gas Ideal adalah gas yang memiliki karakteristik (1) gaya tarik antar molekul sangat lemah sehingga dapat diabaikan dan (2) volume moleku penyusun gas sangat kecil sehingga gas-gas bergerak secara bebas-acak. Pada gas-gas nyata, tidak demikian. Terdapat gaya tarik antar molekul bekerja di masing-masing molekul yang tidak bisa diabaikan, terdapat gaya tarik menarik (kohesi) antara dinding dan molekul gas. Terakhir, Volume Molekul pada gas nyata tidak bisa diabaikan. Dengan demikian nilai P-V dalam persamaan gas ideal harus dikoreksi. Van Der Waals membuat percobaan untuk mengamati koreksi tersebut pada tahun 1873.
1. Tekanan Kohesi
Tekanan kohesi adalah tekanan yang terjadi pada molekul gas terhadap dinding ruangan, tekanan ini disebut juga sebagai tekanan termal. Besar tekakan ini juga dipengaruhi oleh gaya kohesi yang terjadi pada saat molekul menambrak dinding pembatas ruang.
Besar gaya kohesi tersebut sebagai berikut :
Semakin banyak jumlah molekul yang ada dalam ruangan akan menambah besar tekanan kohesi sebalik jika ruangan semakin besar maka peluang untuk menumbuk dinding akan semakin kecil dengan berbading terbalik dengan volume maka :
P_{Kohesi}∝\frac{n}{V}Karakteristik tekanan kohesi juga berbanding lurus dengan kerapatan molekul gas dengan demikian maka Tekanan Kohesi untuk gas a dan b dapat ditulis :
P_{Kohesi}∼\frac{n}{V} ∼\frac{n}{V}P_{Kohesi}∝\frac{n^2}{V^2}atau
P_{Kohesi}=\frac{an^2}{V^2}dimana a adalah sebuah konstanta.
Gaya antar molekul dalam gas akan membuat tekanan gas semakin rendah (asumsinya gerak gas semakin tidak bebas) maka Tekanan gas nyata dapat dituliskan dalam bentuk
Pnyata = Pideal – PKohesi
P = P_{ideal}-\frac{an^2}{V^2}Volume fisik molekul gas
Volume fisik sebuah molekul gas nyata disebut b, maka volume fisik totoal sebuah gas adalah nb. Volume ruang yang menampung gas tidak lain adalah volume gas dan volume bebas dari gas itu sendiri sehingga :
V = nb +\frac{nRT}{P}besar nilai b ini terggantung dari gas. Persamaan diatas dapat disusun ulang dengan persamaan :
P=\frac{nRT}{V-nb}Masukkan faktor koreksi Van Der Waals pada persamaan di atas sehingga persamaanya berubah menjadi :
P=\frac{nRT}{V-nb} - \frac{an^2}{V^2}atau
\left ( P+\frac{n^2a}{V^2} \right )\left (V-nb \right )=nRTPersamaan ini disebut sebagai persaman tekanan Van Der Waals dengan nila a dan b bergantung dari jenis gas yang diamati. Suku a dinyatakan dalam satuan tekanan atm.liter2/mol2 dan b dalam liter.mol–
Tetapan Van Der Waals untuk beberapa gas
| Gas | a (atm.liter2/mol2) | b(liter.mol–) |
| H2 | 0,244 | 2,66.10-2 |
| Helium | 0,034 | 2,37.10-2 |
| Nitrogen | 1,39 | 3,91.10-2 |
| CO2 | 3,59 | 4,28.10-2 |
Leave a Reply
You must be logged in to post a comment.