AhmadDahlan.NET – Persamaan Van Der Waals berhasil mendefenisikan hubungan antara tekanan dan volume gas pada tekanan yang cukup tinggi namun tidak pada gas dengan tekanan yang tinggi. Kammerlingh Onnes kemudian mengembangkan persamaan untuk memahami perilaku gas nyata pada tekanan tinggi yang disebut dengan persaman virial, bentuk umumnya adalah :
\[P\bar V=RT\left ( 1+\frac{B}{\bar V} +\frac{C}{\bar V^2}+\frac{D}{\bar V^3}+… \right )\]dimana B, C, D dan seterusnya adalah koefisien virial kedua, ketiga dan seterusnya. Koefisien tersebut memiliki nila yang berubah terhadap suhu dan tergantung dari jenis gas yang diamati.
Untuk gas-gas Van Der Waals, Koefisien virial bisa diapatkan melalui perbadingan persamaan ditas dengan persaman virial dapat ditulis dalam bentuk :
\[Z=\frac{P \bar V}{RT}=1+\frac{B}{V}+\frac{C}{\bar V^2}\]Sedangkan persamaan Van Der Waals dapat ditulis ke dalam bentuk :
\[Z=\frac{P \bar V}{RT}=\frac{1}{1-b/ \bar V}-\frac{a}{RT\bar V}\]Kedua persamaan Z di atas fungsi dari Volume. Untuk suku suku yang tinggi, harga dari 1/V semakin kecil sehingga pada kondisi tertentu dapat diabaikan.
Pada keadaan dengan tekanan rendah, volume gas sangat besar sehingga suku b/V sehingga suku pada ruas kanan Persamaan Van Der Waals 1/(1-b/V) dapat diselesaikan dengan menggunakan deret :
\[\frac{1}{1-x}=1+x+x^2+x^3+…\]Dengan demikian persamaan Virial Z dapat dituliskan dalam bentuk :
\[Z = 1+ \frac{b}{\bar V}+\left ( \frac{b}{\bar V} \right )^2+…-\frac{a}{RT\bar V}\]bisa dituliskan ulang agar sukunya rapi :
\[Z=1+\left (b-\frac{a}{RT} \right )\left ( \frac{1}{\bar V}\right )+\left ( \frac{b}{\bar V} \right )^2+…\]dimana :
\[B= \left (b-\frac{a}{RT} \right )\]dan
\[C= b^2\]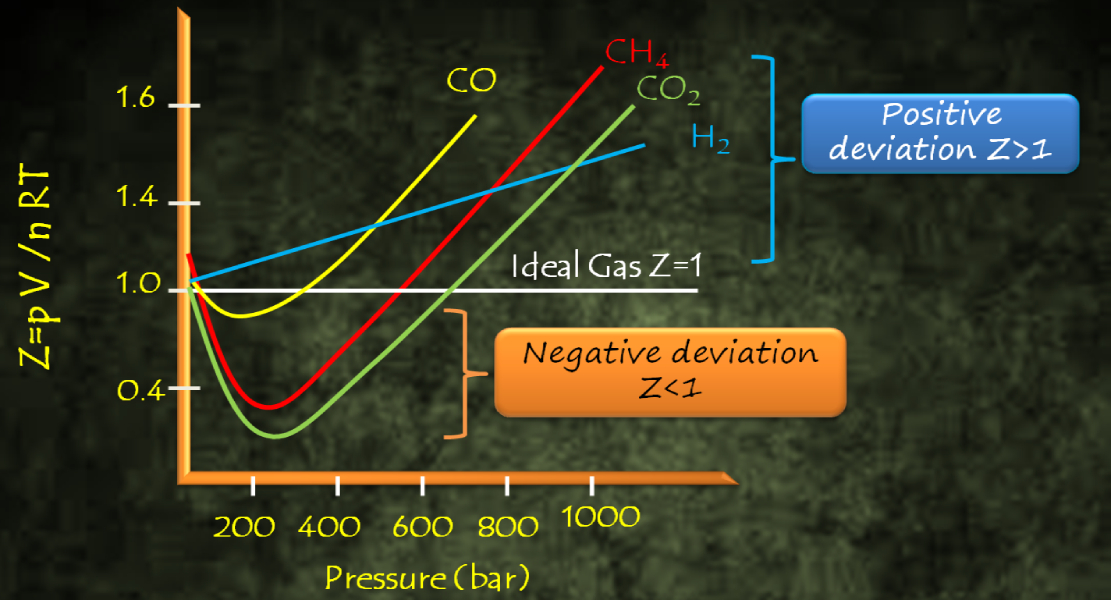
Leave a Reply
You must be logged in to post a comment.